Türkiye’nin Alzheimer Haritası
Ön Söz
Herhangi bir şeyi öğrenmek ve deneyimlemek için hafızaya ihtiyacımız vardır. Hafıza bu bakımdan yaşamlarımızın anlatısını ve kimliğini oluşturur. Konuşmak, saçınızı taramak, çocuğunuzu aramak, şarkı söylemek, araba kullanmak vb. için hafızaya ihtiyaç duyarsınız. Hafıza, zekâ değildir ama zekâdan çok daha önemli ve yaşamsaldır. Yaşam kalitesini önemli ölçüde etkileyen hafızanın bireysel ya da toplumsal olarak kayba uğraması hem kişiler hem de toplumlar için büyük felaketlere neden olabilir. Dolayısıyla hafızaya karşı tüm tehditleri iyi değerlendirmek ve süreçlerini anlamak, insana ve topluma yarar çalışmalar ortaya koyabilmek adına büyük önem taşımaktadır. “Türkiye’nin Alzheimer Haritası” isimli raporumuz bu ehemmiyetle ortaya konmuş ve Ensitümüzün toplum araştırmaları alanlarında yaşlanma sosyolojisi temasında değerlendirilmiştir.
Alzheimer hastalığı, yaşlanan nüfus arasında daha sık görülmesi muhtemel nörodejeneratif bozukluklardan biridir ve genellikle hafıza kaybı, bilişsel fonksiyonlarda azalma ve günlük aktiviteleri yerine getirme yeteneğindeki düşüşle karakterize edilir. Türkiye gibi yaşlı nüfus oranı artış eğiliminde olan ülkeler için Alzheimer ve benzeri hastalıkların nedenleri doğru tespit edilmeli, erken müdahale yöntemleri ortaya konmalı ve bu hastalıkların neden olabileceği bireysel ve toplumsal etkiler dikkatle değerlendirilmelidir. Bu araştırmanın amacı da Türkiye’nin yaşlanma eğilimlerini göz önünde bulundurarak bahsi geçen hastalıklarla ilgili bireysel, toplumsal ve politik adımları netleştirmek ve yaşlanma süreçlerini ülkemizde daha kaliteli ve işlevsel hale getirmek için modeller sunmaktır.
Kaliteli yaşlanma kavramı, bireylerin yaşam kalitesini en elverişli düzeye çıkarmaya, hastalıkları yönetmeye ve yaşlılık dönemlerini mümkün olduğunca aktif, işlevsel ve bağımsız geçirmeye odaklanır. Kaliteli yaşlanma sürecinde Alzheimer hastalığına karşı alınabilecek önlemler, hastalığın etkilerini hafifletmeye ve ilerlemesini yavaşlatmaya yardımcı olabilir. Bu çalışma, Türkiye’de yaşanan Alzheimer vakalarının detaylı analizinden hareketle Alzheimer hastalığına sebep olan öncül hastalıklara dikkat çekmekte ve hastalığın coğrafi ve sosyolojik seyrine işaret etmektedir. Bu bakımdan sosyal etkileşim, işlevsellik ve zihinsel aktiviteler Alzheimer’ın önlenmesinde ve kaliteli yaşlanmada önemlidir. Türkiye’de yaşlıların dünyadaki akranlarına göre daha erken dönemlerde işlevsizleşmesi ve tabiri yerindeyse erken dönemde “eleğini duvara asma” kararı niteliksiz bir yaşlanma sürecini başlatmaktadır. Bu ve benzeri toplumsal alışkanlıklarımız yaşlanan nüfusumuz için de risk oluşturmaktadır.
Henüz Alzheimer hastalığına kesin çözüm sunan bir tedavi geliştirilmemiş olsa da hastalığın şiddetini ve süreçlerini daha iyi yönetebilmek mümkündür. Bu konuda bireysel çabalar kadar güçlü bir toplumsal desteğe ve buna uyumlu politikalara ihtiyaç söz konusudur. Araştırmanın bu bakımdan önemli bir yol haritası ve rehber olacağına inanıyorum.
İpek COŞKUN ARMAĞAN
Yönetici Özeti
-
Türkiye’nin Alzheimer Haritası Raporu, demans hastalıklarının genel tanımını ve Alzheimer hastalığının (AH) demans türleri arasındaki önemini vurgulayan kapsamlı bir inceleme sunmaktadır. Ayrıca, bu hastalıklarla ilişkili biyobelirteçler ve önleyici çalışmaların önemi de ele alınmaktadır.
- Türkiye’nin Alzheimer Haritası Raporu özellikle AH tanısı öncesi süreçte ortaya çıkan biyobelirteçlerin ve ilişkili hastalıkların önemini vurgularken, hipertansiyon, hiperlipidemi, diyabet gibi kronik hastalıkların AH ile olan ilişkisine dair literatürdeki bulgulara da yer vermektedir.
- Bu rapor, AH ve demans hastalıklarının çeşitli kronik hastalıklarla olan ilişkisini, hastaların AH/demans tanısı öncesi ve sonrası süreçte deneyimledikleri hastalıklar açısından incelemektedir.
- Bu çalışmadaki veriler, Türkiye Cumhuriyeti Sağlık Bakanlığının e-nabız sisteminden alınmıştır. Bu veriler üzerinden pre/post hastalıkların yaygınlığı, ilişkileri ve gelişim süreçleri analiz edilmiştir.
- Araştırmanın amacı, AH/demans tanısı almış bireylerin, tanı öncesi ve sonrası dönemde deneyimledikleri hastalıkların sıklığını, bu hastalıklar arasındaki ilişkileri ve bu ilişkilerin zamansal boyutunu analiz etmektir. Bu kapsamda, toplam 65 yaş üstü bireylerin verileri üzerinde gerçekleştirilmiş ve tanı öncesi ile sonrası süreçte hastalıkların yaygınlıkları, zamansal olarak incelenmiştir.
- Bulgular, AH/demans tanısı almış bireylerin tanı öncesinde belirli kronik hastalıkları daha yüksek oranda deneyimlediklerini ve bu hastalıkların AH/demans tanısı sonrası süreçteki dağılımlarını ortaya koymaktadır.
- İlgili araştırmanın sonuçları, AH ve demans hastalıklarının erken teşhis ve önlenmesi konusunda önemli ipuçları sunmakta olup AH/demans tanısı almadan önce kronik hastalıkların yönetiminin önemini vurgulamaktadır.
Raporda ön plana çıkan temel bulgular şu şekildedir:
- Yaygın Kronik Hastalıklar: AH ve diğer demans hastalıkları tanısı almış bireylerde en yaygın görülen kronik hastalıklar hipertansiyon, diyabet, hiperlipidemi ve psikolojik rahatsızlıklardır. Bu hastalıklar, AH/demans tanısı almadan yıllar önce gelişmeye başlamaktadır. Özellikle hipertansiyon, tanıdan yaklaşık üç yıl önce ortaya çıkmakta ve diğer kronik hastalıklarla güçlü ilişkiler sergilemektedir.
- Pre ve Post Tanı Döneminde Hastalık Yaygınlığı: AH/demans tanısı öncesinde 2-5 farklı hastalığa sahip olma olasılığı yüksektir. Tanı sonrası dönemde ise herhangi bir hastalık tanısı almamış bireyler en büyük grubu oluşturmakta, takiben bir hastalık tanısı almış olanlar gelmektedir. AH/demans sonrası dönemde ise toplam hastalık sayısında genel olarak azalma görülmektedir.
- Hastalıklar Arasındaki İlişkiler: Preklinik süreçte, AH/demans tanısı almış bireylerde hipertansiyon ve diyabet arasında güçlü bir ilişki gözlenmiştir. Ayrıca hiperlipidemi, psikolojik temelli hastalıklar ve koroner arter hastalığı arasında ters yönlü bir ilişki mevcuttur. Bu bulgular, özellikle hipertansiyon ve diyabetin, AH riskini artıran önemli faktörler olduğunu göstermektedir.
- Coğrafi Farklılıklar: Türkiye’de AH/demans tanısı almış bireyler arasında bölgesel farklılıklar da tespit edilmiştir. Marmara, Akdeniz ve Karadeniz bölgelerinde bu hastalıkların görülme sıklığı ülke ortalamasının üzerindedir. Bu durum, bölgesel sağlık politikalarının önemine işaret etmektedir.
- Alzhemier’ı Önleyici Çalışmaların Önemi: Alzheimer’ın önlenebilirliği, hastalığın semptomları ortaya çıkmadan önce, risk faktörlerinin belirlenmesi ve bu risklerin etkin bir şekilde yönetilmesiyle mümkün olabilir. AH’nin gelişiminde kronik hastalıklarla olan bağlantılar önemli bir rol oynar. Bu nedenle, AH’nin önlenmesinde, kronik hastalıkların genel fizyoloji ve vasküler sistem üzerindeki uzun vadeli etkilerini minimize etmek gereklidir. Moleküler dejenerasyonun yarattığı patolojik bulgular, aslında AH’nin temel nedeni olmayıp, kronik hastalıkların uzun süreli kademeli hasarının bir sonucu olarak ortaya çıkar. Bu bağlamda, Alzheimer’ın önlenmesi için kronik hastalıkların yönetimi ve bu hastalıkların beyin üzerindeki etkilerinin azaltılması kritik önem taşır.
Bu bulgular çerçevesindeki sonuçlarımız ve önerilerimiz şu şekildedir:
- Bu çalışma, AH ve demans hastalıklarının tanı öncesi süreçte çeşitli kronik hastalıklarla olan ilişkisini detaylandırarak bu hastalıkların erken teşhis ve önleyici sağlık hizmetleri açısından ne kadar kritik olduğunu ortaya koymakta ve konuyla ilgili stratejik hedefi göstermektedir.
- Özellikle hipertansiyon, diyabet ve hiperlipideminin AH riskini artırdığı görülmekte olup bu hastalıkların erken teşhisi ve yönetimi, demans hastalıklarının önlenmesinde etkili bir strateji olarak değerlendirilmektedir. Bu bağlamda, bölgesel farklılıkların dikkate alınarak sağlık politikalarının geliştirilmesi halk sağlığı açısından önemli bir adım olacaktır.
- Çalışma, AH/demans hastalıkları ile kronik hastalıklar arasındaki ilişkilerin daha iyi anlaşılmasını amaçlamış ve bu hastalıkların yönetimi için yeni bakış açıları sunmuştur.
- AH/demans hastalıklarına yönelik önleyici stratejiler geliştirilmeli ve ilgili hastalıkların tedavilerinin artırılmasına dair kalıcı adımlar atılmalıdır.
- Alzheimer hastalığı ve diğer demans türlerinin tanı ve tedavisinde, hastaların demografik (yaş, cinsiyet) ve coğrafi özelliklerini dikkate almak önemli bir katkı sunabilir. Yaş, cinsiyet ve coğrafi farklılıklar bu hastalıkların gelişiminde rol oynayan temel faktörlerdir; bu nedenle, yaşa ve cinsiyete göre uyarlanmış stratejiler geliştirmek hastalığın erken teşhisini ve etkili tedavisini sağlayabilir.
Giriş
Demans, beynin aldığı hasar sonucunda, hafıza, düşünce ve davranışlarda olumsuz yönde etkilenmelerin meydana geldiği hastalıkları tanımlayan bir kavramdır. Günümüzde, yaklaşık 55 milyon kişinin demans hastalıklarından en az birini deneyimlediği bilinmektedir. Bu kişilerin %60’a yakını ise düşük ve orta gelir grubundaki ülkelerde ikamet etmektedir (1).
Demans hastalıkları arasında en bilineni ise 1906 yılında keşfedilen Alzheimer hastalığıdır (AH) (2). Tüm demans hastalıklarının yaklaşık %70’ini oluşturan AH, erken, orta ve son evre olmak üzere temel becerilerin kaybına kadar giden gelişimsel karakteristiğe sahip bir hastalıktır (3; 4). PET, MR nörogörüntüleme tekniklerinin yanı sıra beyin omurilik sıvısının incelenmesi gibi teknikler AH teşhisinde kullanılmaktadır. Ayrıca tükürük ve kan testlerinin de bu yöntemler arasında kullanılabildiği bilinmektedir (5; 6). Tüm bu çalışmalara rağmen günümüzde AH’nin kesin bir tedavisi bulunmamaktadır (7). Geliştirilen tanı ve ilaç tedavisi tekniklerinin toplam maliyeti ise dünya genelinde yıllık 1,3 trilyon dolardır (1). Bu maliyetin 2050 yılında, 9 trilyon doları aşacağı tahmin edilmektedir (8).
Tedaviye ilişkin girişimlere ek olarak AH ve demans hastalıkları için önleyici çalışmaların önemi vurgulanmaktadır. Nitekim günümüzdeki tüm demans hastalıklarının %40’a varan oranlarda önlenebilir/geciktirilebilir olduğu tartışılmaktadır (9). Önleme ve geciktirmeye yönelik tartışmalar, kişilerin belirti göstermeden önceki süreçte demans hastalıklarına yakalanmalarına ilişkin risk düzeylerinin belirlenmesini gerekli kılmaktadır. Bu durum, uzun yıllardır AH özelinde, demans biyobelirteçlerine olan ilgiyi arttırmıştır. Günümüzde amyloid B birikimi, tau proteini üzerindeki patolojiler, serebral hipometabolizma ve beyinde gerçekleşen yapısal deformasyonlar; AH ve diğer demans hastalarının belli başlı biyobelirteçleri olarak düşünülmektedir. Toplamda 200 kişinin katılımı ile gerçekleştirilen bir çalışmada, Aβ birikiminin demans tanısı öncesinde, 20 yıla kadar geriye gidebildiğini göstermektedir. Serebral hipometabolizma sürecinin tanı öncesindeki 10-15 yıllık zaman aralığında ortaya çıktığını gösteren kanıtlar, beyindeki yapısal değişikliklerin ise tanı öncesindeki 5 yıllık süreçte ortaya çıktığını göstermektedir (10; 11; 12). Benzer biçimde, Tau-181 ve T-Tau göstergelerine ilişkin değerler, AH tanısı almış bireylerde, almamış olanlara göre anlamlı ölçüde yüksek çıkmaktadır (5). Bununla birlikte tanı sonrası sürece ilişkin olarak belirli periyotlarda tau değerlerinde artış gözlemlenebilirken Aβ birikimi için anlamlı bir değişiklik gözlenmemektedir (13).
Ayrıca normal beyin fonksiyonunun bileşenlerinden olan astrositlerin tepkisel olmasının, Aβ birikimi ve tau proteini patolojileri ile ilişkili olduğu değerlendirilmektedir. Ayrıca astrositlerin, amiloid plakların bir bileşeni olduğu ortaya konmuştur. Bu temelde, astrositlerin bir başka biyobelirteç olarak değerlendirilebileceği tartışılmaktadır (14; 15; 16).
- Tanımlar
Alzheimer: Genellikle yavaş yavaş başlayan ve giderek kötüleşen nörodejeneratif bir hastalıktır ve bunama (demans) vakalarının %60-70’inin nedenidir. Alzheimer, aynı zamanda en yaygın görülen demans türüdür. Beyin hücrelerinin zamanla ölümüne bağlı olarak hafıza kaybı, demans ve genel anlamda bilişsel fonksiyonların azalması şeklinde gelişen tıbbi durum, Alzheimer hastalığı olarak adlandırılır.
Demans: Beyinde, hasardan kaynaklanan ve ilerleyen bir bozukluk olup kişinin yaşından beklenen beyin performansını gösterememesidir. Özellikle etkilenen bölgeler; hafıza, dikkat, dil ve problem çözme alanlarıdır. Durumun ileri aşamalarında kişi; zaman, yer ve kişi oryantasyonunu kaybeder.
Kronik Hastalık: Kronik hastalıklar, genellikle uzun süreli ve kalıcı etkileri olan sağlık sorunlarıdır. Bu tür hastalıklar, tedavi gerektirebilir ve kişinin yaşam kalitesini düşürebilir, sosyal faaliyetlerinde kısıtlamalar oluşturabilir. Kronik hastalıklar, birçok faktöre bağlı olarak ortaya çıkar ve kişinin yaşamı boyunca devam ederek hayat kalitesinde azalmaya neden olur. Hastalığın başladığı ilk anda, belirtiler henüz tam olarak kendini göstermediği için birey ve sağlık sistemi tarafından tespit edilmesi çok zor olabilir.
Bağlantısallık: Karmaşık sistemleri anlama ve tanımlamada kullanılan bir kavramdır. Bağlantılılığın kavramsallaştırılması ve işlevselleştirilmesi, büyük ölçüde kendi disiplin sınırları içerisinde gelişmiştir. En basit hâliyle bağlantısallık, bir sistem içindeki bağlantılılık düzeyinin tanımıdır ve mekânsal veya zamansal olarak farklı varlıklar arasındaki yapılandırılmış ilişkiler dizisine karşılık gelir. Karmaşık sistemler, genellikle birden fazla organizasyon ve ölçek düzeyindeki dinamik ilişkiler yolu ile bütünün davranışını oluşturan, sürekli değişen bileşenler arasında doğrusal olmayan ilişkiler sergiler. Bundan dolayı bağlantısallık, karmaşık sistemlerin anlaşılmasında ve tanımlanmasında dönüştürücü bir kavramdır.
- Literatürde Alzheimer ve Kronik Hastalıklar İlişkisi
Alzheimer özelinde demansa ilişkin öncül faktörler, yalnızca bu kimyasal değerler ile sınırlı değildir. Günümüzde, çeşitli hastalıkların demans tanısı almış kişilerdeki yaygınlığı, bu hastalıklar ile demans ve özelde Alzheimer arasında bir ilişki kurulabileceğini göstermektedir. Bu hastalıklardan bir tanesi hipertansiyondur. Yüksek kan basıncının, beynin kılcal damarlara zarar verme yoluyla hafıza ve düşünceden sorumlu bölgelerine zarar verdiği bilinmektedir.
Bu yargıyı destekleyecek şekilde, çeşitli araştırmalarda, yüksek tansiyonun Alzheimer ve diğer demans hastalıkları için bir risk faktörü olduğu belirlenmiştir (17; 18). 209 farklı çalışmanın sonuçları üzerinden ise hipertansiyon ile, demansın da içinde bulunduğu zihinsel hastalıklar arasında pozitif yönlü bir ilişki belirlenmiştir (19). Başka bir çalışmada, hipertansiyon hastalarından en az %30 düzeyinde, orta düzey bilişsel hasar (mild cognitive impairment-MCI) olduğu ortaya konmuştur (20). Benzer biçimde, 92 farklı kişi üzerinde gerçekleştirilen bir çalışmada, hipertansiyon tanısı almış kişilerin, istatistiksel olarak anlamlı ölçüde daha düşük bilişsel becerilere sahip olduğu belirlenmiştir (21). Ayrıca toplamda bir buçuk milyondan fazla kişi ile gerçekleştirilmiş çalışmaların incelendiği bir meta-analizde, antihipertansif ilaç kullanımının Alzheimer hastalığına karşı koruyucu bir faktör olduğu belirlenmiştir (22).
Hipertansiyonun yanı sıra hiperlipidemi de Alzheimer ile ilişkilendirilen hastalıklar arasındadır. Japonya’daki 113 Alzheimer hastası üzerinde yapılan bir çalışmada, hipertansiyon yaygınlığı %42, lipid bozuklukları ise %48 düzeyindedir (23). Statin kullanımının Alzheimer tanısı alma üzerindeki etkisinin incelendiği bir çalışmada, statin kullanımının Alzheimer tanısı alma ihtimalini arttırmadığı tespit edilmiştir (24). Başka bir çalışmada, genetik yatkınlıkla ortaya çıkan yüksek yoğunluklu lipoprotein kolesterol (HDL) ve yüksek tansiyondaki artışın Alzheimer riskini artırdığı tespit edilmiştir (25).
Hipokampüste, yoğun olarak yer alan insülin reseptörlerinin çalışma prensibine aykırı yapısal dejenerasyonla ortaya çıkan diyabet, bu yönüyle demans ile yakından ilişkilidir (26). Nitekim özellikle Alzheimer ile vasküler demans tanısı almış bireylerde, diyabet yaygın olarak görülmektedir (27; 28; 29). Toplamda 466 bin kişinin verileri ile gerçekleştirilen bir çalışmada, özellikle 45 yaş öncesi diyabet tanısı alanlarda, demans riski %190 daha yüksek olarak hesaplanmıştır (30). Bu bulguları destekler nitelikteki çeşitli çalışmalarda, diyabet tanısı almış olmanın demans riskini 2 ila 4 kat arasında artırdığı tespit edilmiştir (26). Ayrıca yüksek Hba1c seviyesinin bilişsel işlevlerdeki zayıflama ile ilişkilendirilebildiği bilinmektedir (31). Tüm bu bulguları destekler nitelikteki bir çalışmada ve diyabet, hipertansiyon, kardiyovasküler hastalıklar, depresyon ve bağırsak hastalıklarının demans ile ilişkisinin incelendiği toplam 41 çalışmada, demans ve bu hastalıklar arasındaki pozitif yönlü ilişki ortaya konmuştur (32).
Bunlara ek olarak çeşitli çalışmalar, depresyon geçmişinin demans riskini artırdığını ve bununla birlikte depresyon şiddeti ile demans olasılığı arasında pozitif yönlü bir ilişki olduğunu göstermektedir (33; 34). Nitekim depresyon tanısının, 20 yıl kadar geniş bir süre zarfında demans tanısı almayla ilişkili olduğu bilinmektedir (35). Depresyon tanısı almış kişilerin beyinlerindeki hipokampüs bölgesinde küçülme gözlenmiştir. Bu durum, depresyon ve Alzheimer ilişkisini açıklamaya yönelik önemli bir referanstır (36; 37). Bir başka çalışmada, Alzheimer hastalığına ilişkin genetik yatkınlığı olduğu kabul edilen bireylerin orta yaş döneminde depresyon deneyimleme riskinin yüksek olduğu tespit edilmiştir (38). Ayrıca beyinde yarattığı hasarla amyloid-β ve tau proteininin, hiperfosforilasyona yol açan oksidatif stresin, depresyon ve Alzheimer ile olan ortak ilişkisi bu iki durum arasında bir ilişki olabileceğini düşündürmektedir. Bununla birlikte yalnızlık ve sosyal izolasyonun demans riskini artırdığına ilişkin çalışmalar da mevcuttur (34).
Bioyobelirteçlere ilişkin bulgular temelinde, AH teşhisi öncesi süreçte gelişmeye başlamış olması ve çeşitli hastalıkların AH ile olan ilişkisi değerlendirildiğinde, tanı öncesi sürecin gelişimsel özelliğinin daha iyi anlaşılmasının gerekliliği ortaya çıkmaktadır. Buradan yola çıkarak bu çalışmanın amacı, AH ve diğer demans hastalıklarının çeşitli hastalıklar ile olan ilişkisini belirli bir zaman aralığında incelemektir.
Araştırma Yöntemi
Bu çalışma, Türkiye Cumhuriyeti Sağlık Bakanlığının izni ile gerçekleştirilmiştir. Çalışmada kullanılan veriler, Bakanlık tarafından geliştirilmiş e-nabız sistemi üzerinden çekilmiştir (39). 2020 yılında AH/demans sorgulamasından geçen 65 yaş üstü ve üzeri bireylerin verileri, retrospektif olarak taranmış ve bu kişiler için veri setinde yer alan değişkenlere ilişkin gözlemler toplanmıştır.
Çalışmanın yöntemini çeşitli veri görselleştirme teknikleri oluşturmaktadır. Literatürde yaygın olarak belirli bir örneklemdeki bireylerin çeşitli hastalıklar ve AH’yi aynı anda deneyimleyip deneyimlemediğine ilişkin çalışmalar mevcuttur. Bundan farklı olarak çalışmamızda, AH/demans tanısı almış olan bireylerin, bu tanıdan önce ve sonraki süreçte tanı alma durumları ile tanı aldıkları hastalıklar arasındaki ilişkilerin ortaya konması hedeflenmektedir. Veri setinde bilgileri yer alan kişilerin tamamı 2020 yılı içerisinde AH/demans tanısı almış kişilerdir.
Bu kapsamda, öncelikli olarak veri setinde yer alan 11 farklı hastalığın, AH/demans tanısı öncesi (pre) ve sonrası (post) için sıklığı incelenecektir. Bunu takiben toplam pre ve post hastalık sayısındaki değişim sunulacaktır. Tablo 1, bu hastalıklara ilişkin bilgileri sunmaktadır.
Çalışmanın esas odağı olan pre ve post hastalıkların AH/demans tanısı ve birbirleri ile olan ilişkileri ise paralel koordinat grafiği (PCG) yöntemi ile elde edilen görsel çıktılar üzerinden incelenecektir. PCG çıktıları, R Studio 4.3.0 yazılımı üzerinden “plotly package” yardımı ile elde edilmiştir (40). Diğer grafik gösterimler ise Microsoft Power BI programında oluşturulmuştur.
Görselleştirmeleri iyileştirmek adına tanı öncesi ve sonrası için on yıllık periyot dikkate alınmıştır. Bu nedenle 120 aydan fazla bir süre önce/sonra hastalık geliştiren ID’lere ilişkin gözlemler veri setinden çıkartılmıştır. Bunun için “pre” veri setinden %1.4, “post” veri setinden %0.23 oranında bir veri kaybı söz konusu olmuştur. Bunun sonucunda, pre hastalık PCG grafiklerinde kullanılan gözlem sayısı AH için 87.065, demans için ise 61.265 şeklindedir. Post hastalık PCG grafiklerinde kullanılan gözlem sayısı ise AH için 87.592, demans için ise 62.194 şeklindedir.
Tablo 1. İncelemeye Alınan Hastalık
|
Hastalık |
ICD 10 |
Kısaltma |
|
Böbrek Yetmezliği |
N14 N19 |
renal.f |
|
Kalp Yetmezliği |
I50 |
heart.f |
|
Atriyal Fibrilasyon |
I48 |
Af |
|
Serebrovasküler |
I64 |
cerebro |
|
Koroner (Arter) |
I25.1 |
coronary |
|
Diabetes Mellitus (Şeker Hastalığı) |
E10 E14 |
diabetes |
|
Hiperlipidemi (Yüksek kolesterol) |
E78.2 E78.4 E78.5 |
h.lipid |
|
Hipertansiyon |
I10 I15 |
h.tension |
|
Kronik Obstrüktif Akciğer Hastalığı (KOAH) |
J44.9 |
Copd |
|
Osteoporoz |
M80 M81 M82 |
osteoporosis |
|
Psikolojik temelli tanılar |
F31 F32 F33 F34.1 F06.3 |
Psy |
Çalışma kapsamındaki analizler, Tablo 1’de belirtilen hastalıkların tanı tarihleri ile kişilerin Alzheimer/demans sorgulamasından geçtiği tarih arasındaki zaman farkı üzerinden gerçekleştirilmiştir. İlgili zaman farkı, ay bazında hesaplanmıştır. AH/demans sorgulamasından en çok 29 gün önce tanı alınan hastalıklar, ilgili pre hastalık tanısı almamış olma durumunu ifade eden “0” değeri yerine “1” (1 ay öncesinde tanı almış) şeklinde kodlanmıştır.
Ayrıca bu incelemeler, kişilerin yaşadıkları coğrafi bölgenin, 65 yaş üstü nüfusa oranla AH/demans oranının ülke ortalaması üstünde veya altında olması durumuna göre derinleştirilecektir. Buna göre AH tanısı alanlar için Akdeniz, Marmara ve Karadeniz (toplam 53.436 kişi pre ve 53.614 kişi post); demans tanısı alanlar için Ege, Marmara ve Karadeniz bölgelerinde (toplam 39.992 kişi pre ve 40.877 kişi post) yaşayan bireylerde, 65 yaş üstü nüfusa oranla AH/demans oranı ülke ortalamasının üstünde yer almaktadır. Diğer bölgelerin ortalaması ülke ortalamasının altındadır.
Ayrıca her bir çizgi, bir kişiyi temsil etmekte olup görsellerdeki sayısal değerler “ay” cinsinden verilmiştir. Her bir sütunun en üstünde ilgili değişkenin ismi yazmakta olup bunun altında yer alan değer, o değişken için maksimum değeri ifade etmektedir. Görsellerdeki “0” değerleri ise tanı almama durumunu yansıtmaktadır.
Türkiye Alzheimer ve Demans Büyük Veri Analizlerinin Görünümü
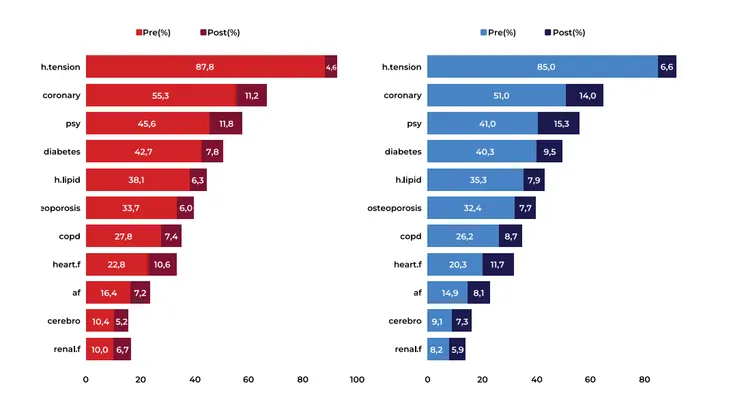
Şekil 1’den anlaşılabileceği üzere bu kişilerdeki en yaygın hastalık hipertansiyondur. Ayrıca her iki grup için de böbrek yetmezliği ve serebrovasküler olay arasındaki farklılık dışında bütün hastalıkların yaygınlığı aynı sıradadır. Diyabet, hiperlipidemi, hipertansiyon, depresyon ve bipolar gibi durumları içeren psikolojik rahatsızlıkların en yaygın beş hastalık arasında bulunması da dikkat çekici bulgular arasındadır.
Şekil 2, iki veri setinde yer alan kişiler için ayrı ayrı olacak şekilde toplam pre ve post hastalık sayılarının dağılımını göstermektedir.
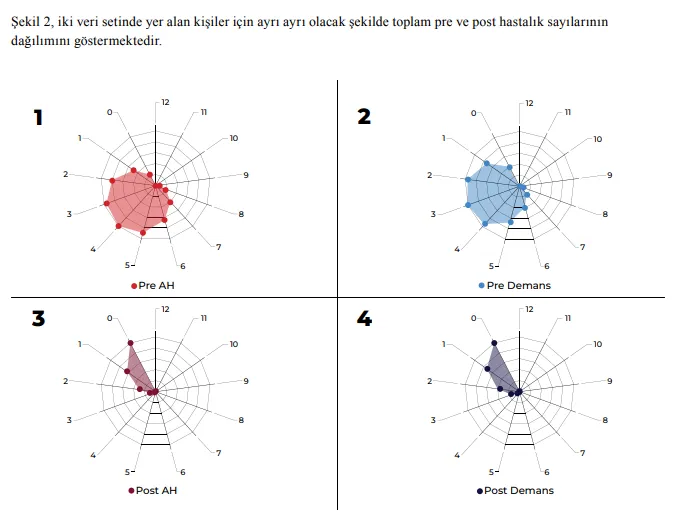
Şekil 2’de 4 farklı grafik gösterimi yer almaktadır. “1” ve “3” nolu grafikler, AH tanısı almış bireylerin toplam pre ve post hastalık sayısının dağılımını sunmaktadır. Buna göre AH tanısı almış bireyler, %64 oranında 2-5 arası pre hastalığa sahip iken %47 oranında hiçbir post hastalığa sahip olmayıp, ancak %30 oranında 1 post hastalığa sahiptir. Demans tanısı almış bireylere ilişkin bilgiler ise “2” ve “4” nolu gösterimlerde sunulmaktadır. Bu gösterimlerden anlaşılabileceği üzere demans tanısı almış bireylerin 2-5 arası pre hastalığa sahip olma oranı %66’dır. Demanslı bireylerdeki post hastalık sayısı ise %42’lik bir oranla 0, %30’luk bir oranla ise 1 şeklindedir. Bu 4 grafik gösterimin özeti olarak AH/demans durumsallığı öncesinde, farklı hastalıklar deneyimleme oranı yüksek iken post süreç için bir hastalık geliştirme oranı görece düşüktür. Şekil 2’den anlaşılabileceği üzere toplam pre hastalık sayısı, her iki grup için de 2-5 aralığında yoğunlaşmaktadır. Buna göre AH/demans tanısı almış bir kişinin, tanı öncesinde 2-5 arası bir hastalığa sahip olma ihtimali yüksektir. Bu durum, literatür taramasından elde edilen bilgiler ve Şekil 1’de sunulan bulgular ile örtüşmektedir. Şekil 2’den çıkartılabilecek bir diğer sonuç da toplam post hastalık sayısı ile ilgilidir. Her iki grup için de AH/ demans tanısı sonrası herhangi bir hastalık tanısı almamış olanlar, en büyük orana sahiptir. AH/demans sonrası 1 tanı almış olanlar, ikinci sırada gelmekteyken toplam 2 veya daha fazla post hastalığa sahip kişi sayısı ise anlamlı ölçüde daha azdır.
Sunulan iki şekilde de pre hastalıkların yaygınlıkları dikkat çekmektedir. Buna istinaden Şekil 3’te, pre hastalıkların AH/demans tanısı alma sürecinin öncesinde, ortalama ne kadar süre önce ortaya çıktığı ay cinsinden sunulmaktadır.
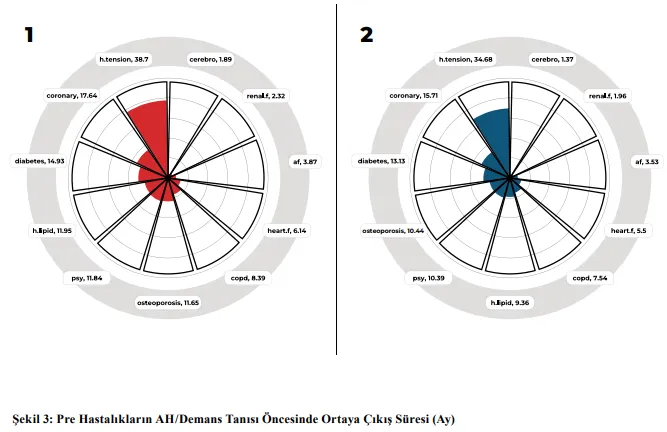
“1” numaralı görsel AH, 2 numaralı görsel ise demans tanılı bireylere ilişkin dağılımı göstermektedir. Şekilden anlaşılabileceği üzere AH/demans tanısı almadan hemen önce ortaya çıkan hastalıklar organ yetmezlikleri ve serobrovasküler olaydır. Hipertansiyon ise yaklaşık 3 yıl önce ortaya çıkmaktadır. Ayrıca AH/demans tanısı almadan önceki 1 yıl ise pre hastalık geliştirme ihtimalinin yüksek olduğu bir dönemdir. Şekil 3’ten anlaşılabileceği üzere morbiditesi en yüksek hastalık olan hipertansiyon, yine her iki grup için de en erken deneyimlenen hastalık olmuştur. Benzer biçimde morbidite sıralamasında ilk beş hastalık arasında yer alan diyabet, hiperlipidemi ve psikolojik rahatsızlıklar en erken deneyimlenen ilk beş hastalık arasındadır. Ek olarak organ yetmezlikleri ve serebrovasküler hastalığın, AH/demans tanısının alınmasından hemen önce ortaya çıktığı görülmektedir. Bu hastalıkların yaygınlığına ilişkin oranlar, önemli bir öngörü sunmakta ise de çalışmanın esas amacı, bu hastalıkların birbirleri ile olan ilişkileri üzerinden AH/demans durumsallığına ilişkin yeni bir açıklama kazandırmaktır. Bununla ilgili olarak PCG çıktılarının yorumlanması gerekmektedir.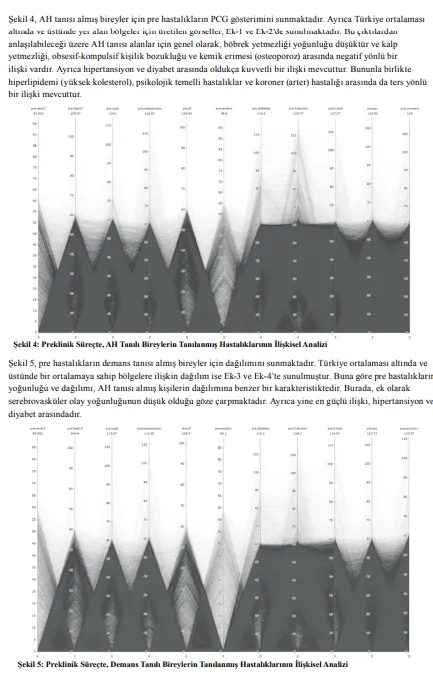
AH tanısı almış bireylere ilişkin PCG çıktıları; tüm veri seti için Şekil 6, Türkiye ortalaması altında ve üstünde olan bölgelere ilişkin ayrım için ise Ek-5 ve Ek-6’da sunulmaktadır. Bununla ilgili olarak hipertansiyon, serebrovasküler olay ve kalp yetmezliği hastalıkları en düşük yoğunluğa sahiptir. Tüm hastalıklar arasında negatif yönlü bir ilişki olmakla birlikte diyabet ve böbrek yetmezliği anlamlı ölçüde daha yoğun biçimde deneyimlenmektedir.
Sonuç ve Öneriler
Son yıllarda AH patolojisinin görüntülenmesinde, biyobelirteçlerin birikiminin ve yaygınlığının izlenmesi ile AH-patogenezi hakkında önemli gelişmeler kaydedildi. AH’nin patolojisini tahminlemede kullanılan kan biyobelirteçlerinin, gelecekte nörodejeneratif süreç başlamadan önce riskin tespit edilmesi ve yönetilmesine yönelik yeni nesil yaklaşımlar ile önleyici tedavi/önleyici tıp müdahalelerinin temelini oluşturacağı düşünülmektedir.
Diğer yandan bugünü anlamak ve geleceğe dair bir içgörü elde etmek için geçmişe bakmak önemlidir. Günümüzde de Aβ birikimi, patolojik tau-proteini ve nörodejenerasyona [AT(N)] odaklanan semptomatik temelli pleiotropik etkilere sahip ilaçların AH için geliştirilmesine yüklenen abartılı beklentiler, tıpkı 1990’lardaki süreci andırmaktadır. Şöyle ki bu dönemde de AH’nin teşhisinde, genetik temelli Aβ tanımlanmış ve hemen ardından tedaviye dönük etkili terapötik ilaçlar geliştirilmesine yönelik iyimser beklentilere gidilmiş, ancak ne yazık ki bu beklentiler, günümüze değin karşılanamamıştır. Bu tür çabalar, değerli ve bir o kadar yol gösterici olmakla birlikte AH’nin farklı perspektifler bağlamında ele alınmasının gerekliliğini ortaya koymakta ve aynı zamanda uzlaşmacı yaklaşımların, değiştirilebilir terapötik stratejilerin sonuç vermemesinin sorgulanması gerektiğini düşündürmektedir.
Günümüze değin AH’nin karakteristik özellikleri ile diğer kronik hastalıklar arasındaki ilişkisellik, birçok bilimsel araştırmaya konu olsa da AH patogenezi ile kronik hastalıklar arasında, zamansal açıdan nasıl bir bağlantısallık geliştiği bütüncül bir bağlamda gösterilememiştir. Bu çalışmanın odağı ise bu stratejik hedefi gerçekleştirme üzerine kuruludur.
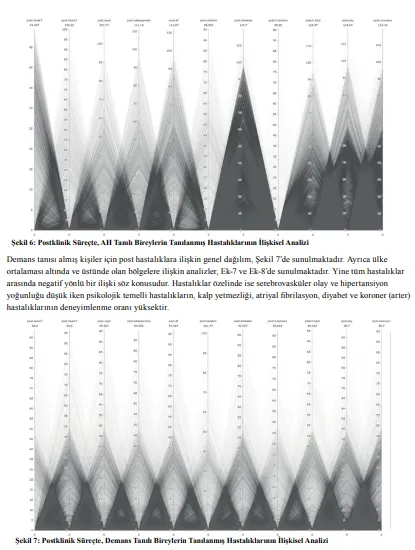
Alzheimer hastalığının semptomların başlamasından 20 yıl veya daha önce başladığına dair nispeten yakın tarihli keşif, hastalığın ilerlemesine müdahale edilebilecek önemli bir zaman dilimi olduğunu göstermektedir. Yine benzer şekilde birçok çalışmada, nöronal ve sinaptik kaybın beyinde başlaması ile eş zamanlı tau-protein patalojisinin yaygınlaştığı ve AH’nin ilk klinik aşamalarında, beyinde uzun süreli gelişime bağlı karmaşık bir patolojinin mevcut olduğu anlaşılagelmiştir (10; 11; 12). Bir çalışmada, semptom görülmesinden 5 yıl önce bilişsel bozuklukların başladığının tespit edilmesinin yanı sıra bu hastaların, AH semptom başlangıcından ancak 3 yıl sonra tanı kriterlerini karşıladığı anlaşılmıştır (11). Yine bir diğer çalışmada, beyinde gerçekleşen yapısal modifikasyonun semptom görülmesinden yine 5 yıl önce başladığı anlaşılmıştır (12). Nitekim Türkiye büyük verisinde, AH tanısı alanların %87.8’inin ağırlıklı olarak AH tanısı almadan 60 ay önce hipertansiyon tanısı aldıkları tespit edilmiştir (bkz. Fig. 4). Hipertansiyon, AH’nin patolojisine giden yolun ilk kapısı gibi görülmekle birlikte buna koraner arter (ort. 18 ay), diyabet (ort.15 ay), hiperlipidemi (ort. 12 ay) ile depresyon (ort. 12 ay) eşlik etmektedir. Preklinik süreçte, son teşhisi konulan kronik hastalıklar; kalp yetmezliği, (ort. 6 ay), KOAH (kronik obstrüktif akciğer hastalığı) (ort. 8 ay), osteoporoz (kemik erimesi) (ort. 11 ay) ve böbrek yetmezliği (ort. 2 ay) gibi organ boyutunda meydana gelen yapısal harabiyet sonucunda oluşan durumlar şeklinde karşımıza çıkmaktadır.
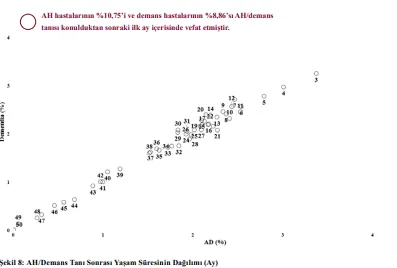
Preklinik sürecin aksine klinik süreçte, AH’li hastaların ağırlıklı olarak anlamlı düzeyde yeni bir kronik hastalık tanısı geliştirmedikleri tespit edilmiştir. Klinik süreçte, AH’li hastalar yeni bir hastalık geliştirse dahi (ort. 0,83) diğer bir hastalık ile bağlantısallık gelişmemektedir. İlgili bulgular Türkiye ortalaması (TO) post genel PCG görselinde görselleştirilmiştir (bkz. Fig. 6). Ayrıca klinik süreçte, AH’li hastaların ortalama yaşam süreleri göreceli olarak kısadır. Bu bulgular, bir nevi AH’nin hastalar için son evre olduğu şekilde yorumlanabilir. Şekil 8 bu hususa ilişkin verilerin dağılımını göstermektedir.
Türkiye’de büyük veri analizleri sonucu elde edilen tüm bu bulgular, preklinik süreçte, AH’nin patogenezine ilişkin doğrudan bağlantısallık içerdiği birçok kronik hastalık ile birlikte ele alınması gerekliliğini ortaya koymaktadır. Dolayısıyla pleiotropik etkilere sahip geliştirilmesi hedeflenen ilaçların, gerçekten dönüştürücü olabilmeleri için sadece işlevsel beyin devrelerinin eski hâline getirilmesi yeterli olmayacaktır. Bu ilaçlar ile diğer kronik hastalıkların etkisiyle oluşan uzun süreli ve özellikle genel vasküler sistemde gelişen harabiyetin değiştirilmesi, bununla da kalmayıp bazal serebral hipometabolizmanın yeniden eski hâline dönüştürülmesini gerektirmektedir. Tüm bu gereklilikler ise en iyi ihtimalle kişinin, AH tanısı almadan yaklaşık 10 yıl öncesindeki genel fizyolojik durumuna karşılık gelmektedir. Çünkü çeşitli çalışmalarda gösterilmiştir ki (10; 11; 12) semptom görülmesinden yaklaşık 10 yıl önce beyin ile ilgili bazal metabolizma hızında yavaşlama (cerebral hypometabolism) tespit edilmiştir.
Çünkü preklinik süreçte, kronik hastalıklar ve bunlar arasındaki kompleks bağlantısallık beynin işlevselliğinde, genel fizyolojide ve vasküler sistemde önemli düzeyde işlevsel kayıplara yol açabilmektedir. Bu işlevsel kayıp, başlangıçta oldukça yavaş ilerlemekte, ancak zamanla her yeni kronik hastalık tanısı ile yerini eksponansiyel ilerleyen bir harabiyet sürecine bırakmaktadır. Preklinik süreçte ortaya çıkan geç evre hastalık tanılarının, AH teşhisinden hemen önce alınıyor olması bunun en önemli göstergesidir. İlgili bağlantısallık haritalamasında bu durum gösterilmiştir (bkz. Fig. 4).
AH’nin önlenebilirliği, öncelikle süreci başlatan ilk kapının (hipertansiyon) açılmamasına bağlıdır. İlk kapı açıldıktan sonra buna yeni hastalıkların (kapıların) eşlik etmesi ve bunlar arasındaki bağlantısallığın karmaşıklık düzeyinin artması, riskin yönetilmesini güçleştirmektedir. Bu semptomsuz yıllar, başta hipertansiyon olmak üzere çeşitli hastalıklara ilişkin tanıların, beyinde hem bilişsel işlev kaybı hem de yapısal modifikasyonun başlamasıyla birlikte bunlara eş güdümlü olarak biyobelirteç patolojisinin gelişimi ve birikimi eşlik etmektedir. Diğer yandan hipertansiyon tanısı alınsa dahi profilaktik müdahalenin odağı, hipertansiyon ve diğer hastalıklar arasındaki bağlantısallığın kırılmasına yönelik olmalıdır. Aksi durumda, bu aşamada henüz mevcut AH tanı kriterleri karşılanmıyor olsa dahi AH kaçınılmaz bir hâl almaktadır. Çünkü preklinik süreçte, AH’ye giden yolda erken değişiklikler meydana gelmeye başladığında, beyin bunları telafi ederek kişilerin normal şekilde işlev görmeye devam etmelerini sağlamaktadır. Ancak bu süreç, ilelebet devam etmeyecektir. Çünkü preklinik süreçte, bilişsel, nörolojik ve davranışsal değerlendirmeye ek olarak kullanılan manyetik rezonans (MR), bilgisayarlı tomografi (BT), beyin görüntüleme teknikleri ile tanının şüpheli olduğu durumlarda ileri yöntemler olarak kullanılan pozitron emisyon tomografisi (PET) ve beyin omurilik sıvısı -cerebrospinal fluid (BOS-csf)- incelemeleri, semptomatik AH kaynaklı yaklaşımdan dolayı sürecin en başından itibaren -yani hipertansiyon gelişimi ile birlikte başlayan nöropatolojiyi tespit edebilecek- çözünürlük ve açıklama gücünden uzaktır. Dolayısıyla mevcut tanılamada kullanılan tekniklerin, AH patolojisini ancak geri döndürülemez eşikte tespit edebildiği anlaşılmaktadır. Bu durum, tıpkı kara delik oluşumu öncesinde maddenin tekillik evresindeki fenomenolojisine benzetilebilir. Böylesine bir evreyi tekrar işlevsel bir hâle dönüştürmeye yönelik hedefler, mevcut kullanılan yöntem ve teknikler düşünüldüğünde olası görülmemektedir. Bu nedenle pleiotropik etkilere sahip tek bir ilaç ya da bir kombinasyon geliştirmeye yönelik çabalar, değerli olmakla birlikte AH’nin karakteristik doğasının ne anlam ifade ettiğinin henüz tam anlamı ile anlaşılamadığını düşündürmektedir. Çünkü AH, semptomatik temelli yaklaşımlar ile anlaşılabilecek bir hastalık karakteristiği göstermemektedir.
Görünen o ki AH’nin önlenebilirliği, mevcut semptomatik temelli yaklaşımların temel aldığı eşikten çok daha önce etkili ve optimize edilmiş profilaktik müdahalelerden geçmektedir. AH’nin önlenebilirliği, gerçek anlamda, riskin belirmesi ile birlikte riskin yönetilebilirliğinin sağlanmasına ve kronik hastalıklar ile arasındaki bağlantısallıkların oluşturduğu modelin kırılmasından geçtiği anlaşılmaktadır. Doğal olarak bu perspektif, Aβ’yı veya tau kaynaklı nörodejenerasyonun izlenmesini ve yönetilebilirliğini de sağlayabilir. Ancak bu noktada anlaşılması gereken önemli husus, moleküler dejenerasyonun yarattığı patolojik bulgular, AH’nin sebebi değil, kronik hastalıkların genel fizyoloji ve vasküler sistemin uzun süreli kademeli harabiyeti sonucunda gelişen sonuçlarıdır.
Özetle Aβ veya tau kaynaklı nörodejenerasyona semptomatik temelli müdahaleler, AH’de terapötik modifikasyon sağlanması bu çalışma bağlamında değerlendirildiğinde olası değerlendirilmemektedir. Moleküler nörodejeneratif düzeydeki birikim ve yaygınlaşma, yalnızca kronik hastalıkların yarattığı harabiyet sürecinin genel fizyoloji, metabolizma ve vasküler sistem içindeki fenomenal sonuçlarıdır. Dolayısıyla AH, tek başına nedensel faktörlerin yarattığı müstakil bir hastalık değil, uzun süreli kompleks bir sürecin sonunda gelişen son kapı (evre) olarak tanımlanabilir.
Yazar Hakkında
Lisans eğitimini Hacettepe Üniversitesinde tamamladı. 2009 yılında Erciyes Üniversitesinden yüksek lisans ve 2015’de Hacettepe Üniversitesinden doktora derecelerini aldı. 2016 yılında İstanbul 29 Mayıs Üniversitesi bünyesinde tam zamanlı öğretim üyesi olarak çalışmaya başladı. Bu süre zarfında, ulusal ve uluslararası makaleler, kitap/kitap bölümleri ve proje çalışmalarını tamamladı. Son yıllarda, akademik çalışmalarını büyük veri tabanlı karmaşık sistemlerin gelişimi ve seyri ile yaşam paternlerine yönelik modellemeler üzerine yoğunlaştıran Yiğit, ayrıca yükseköğretim kurumlarında kalite güvencesi sistemi, akademik verimlilik ve bilimsel bilginin dönüştürme potansiyeline ilişkin veri temelli akademik çalışmalar yürüttü. Özellikle Türkiye büyük verisi ile Alzheimer ve demans grubu hastalıkların tanı öncesi ve sonrası gelişimine yönelik gerçekleştirmiş olduğu çalışmalar, önemli uluslararası dergilerde yayımlandı. Halen geleceğin yeni nesil eğitim modelleri üzerine çalışmalar yapmakta, ayrıca İstanbul 29 Mayıs Üniversitesinde Kalite Birimi Koordinatörlüğü görevini de sürdürmektedir.
Kaynakça
Abdulrahman, H., Dalen, J. W., Brok, M., Latimer, C. S., Larson, E.B., & Richard, E. (2022). Hypertension and Alzheimer’s Disease Pathology at Autopsy: A Systematic Review. Alzheimer’s & Dementia, 18(11), 2308–2326. https://doi.org/10.1002/alz.12707
Adesuyan, M., Jani, Y. H., Alsugeir, D., Cheung, E. C. L., Chui, C. S. L., Howard, R., Wong, I. C. K., & Brauer, R. (2022). Antihypertensive agents and incident Alzheimer’s disease: A Systematic Review and Meta-Analysis of Observational Studies. The Journal of Prevention of Alzheimer’s Disease, 9(4), 715–724. https://doi.org/10.14283/jpad.2022.77
Bateman, R. J., Xiong, C., Benzinger, T. L., Sullivan, D., Goate, A., & Fagan, A. M. (2012). Clinical and Biomarker Changes in Dominantly Inherited Alzheimer’s Disease. The New England Journal of Medicine, 367(9), 800-809.
Berchtold, N. C., & Cotman, C. W. (1998). Evolution in the Conceptualization of Dementia and Alzheimer’s Disease: Greco-Roman Period to the 1960s. Neurobiology of Aging, 19(3), 173-189. https://doi.org/10.1016/s0197-4580(98)00052-9
Birinci, Ş. (2023). A Digital Opportunity for Patients to Manage Their Health: Turkey National Personal Health Record System (The e-Nabız). Balkan Medical Journal. https://doi.org/10.4274/balkanmedj.galenos.2023.2023-2-77
Buchhave, P., Blennow, K., Zetterberg, H., Stomrud, E., Londos, E., Andreasen, N., Minthon, L., Hansson, O. (2009). Longitudinal Study of CSF Biomarkers in Patients with Alzheimer’s Disease. PLoS ONE, 4(7), e6294. https://doi.org/10.1371/journal.pone.0006294
Carrera-González, M. P., Cantón-Habas, V., & Rich-Ruiz, M. (2022). Aging, Depression, and Dementia: The Inflammatory Process. Advances in Clinical and Experimental Medicine, 31(5), 469–473. https://doi.org/10.17219/acem/149897
Carter, S. F., Herholz, K., Rosa-Neto, P., Pellerin, L., Nordberg, A., & Zimmer, E. R. (2019). Astrocyte Biomarkers in Alzheimer’s Disease. Trends in Molecular Medicine, 25(2), 77–95. https://doi.org/10.1016/j.molmed.2018.11.006
Cole, J., Costafreda, S. G., & McGuffin, P. (2011). Hippocampal Atrophy in First Episode Depression: A Meta-Analysis of Magnetic Resonance Imaging Studies. Journal of Affective Disorders, 134(1-3), 483-487. https://doi.org/10.1016/j.jad.2011.05.057
Ebrahimpour, S., Zakeri, M., & Esmaeili, A. (2020). Crosstalk Between Obesity, Diabetes, and Alzheimer’s Disease: Introducing Quercetin as an Effective Triple Herbal Medicine. Ageing Research Reviews, 62, 101065. https://doi.org/10.1016/j.arr.2020.101095
European Alzheimer’s & Dementia Biobank Mendelian Randomization (EADB-MR) Collaboration. (2023). Genetic Associations Between Modifiable Risk Factors and Alzheimer Disease. JAMA Network Open, 6(5), e2328700. https://doi.org/10.1001/jamanetworkopen.2023.13734
Fan, Z., Lu, Y., Zhang, C., Wang, Y., & Xu, Y. (2023). Salivary Aβ1–42 May Be A Quick Tested Biomarker for Clinical Use. Journal of Neurology, 270(7), 1945–1954.
Ferrari-Souza, J. P., Ferreira, P. C. L., Bellaver, B., Tissot, C., Wang, Y. T., Leffa, D. T., Brum, W. S., Benedet, A. L., Ashton, N. J., De Bastiani, M. A., Rocha, A., Therriault, J., Lussier, F. Z., Chamoun, M., Servaes, S., Bezgin, G., Kang, M. S., Stevenson, J., Rahmouni, N., Pallen, V., Poltronetti, N. M., Klunk, W. E., Tudorascu, D. L., Cohen, A. D., Villemagne, V. L., Gauthier, S., Blennow, K., Zetterberg, H., Souza, D. O., Karikari, T. K., Zimmer, E. R., Rosa-Neto, P., Pascoal, T. A. (2022). Astrocyte Biomarker Signatures of Amyloid-β and Tau Pathologies in Alzheimer’s Disease. Molecular Psychiatry, 27(11), 4781–4789. https://doi.org/10.1038/s41380-022-01716-2
Francese, R., Smith, J., & Doe, A. (2022). Identifying the Correlation Between Alzheimer and Type 2 Diabetes. In Proceedings of the 26th International Conference on Information Visualisation. https://www.researchgate.net/publication/367369627_Identifying_the_Correlation_between_Alzheimer_and_type_2_Diabetes
Garcia-Alberca, J. M., Morales, J., Sanchez, M. A., & Garcia, J. (2020). White Matter Lesions and Temporal Atrophy are Associated with Cognitive and Neuropsychiatric Symptoms in Patients with Hypertension and Alzheimer’s Disease. International Journal of Geriatric Psychiatry, 35(12), 1292–1300.
Gordon, B. A., Blazey, T. M., Su, Y., & Fagan, A. M. (2018). Spatial Patterns of Neuroimaging Biomarker Change in Alzheimer’s Disease. The Lancet Neurology, 17(3), 241-250.
Holmquist, S., Nordstrom, A., & Nordstrom, P. (2020). The Association of Depression with Subsequent Dementia Diagnosis: A Swedish Nationwide Cohort Study From 1964 to 2016. Plos Medicine, 17(1), e0227765. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6952081/
Hsu, D. C., & Marshall, G. A. (2017). Primary and Secondary Prevention Trials in Alzheimer Disease: Looking Back, Moving Forward. Current Alzheimer Research, 14(4), 426-440. https://doi.org/10.2174/1567205013666160930112125
Janoutova, J., Janout, V., & Hrstka, R. (2022). Is Alzheimer's Disease a Type 3 Diabetes? A Review. Central European Journal of Public Health, 30(3), 139–143. https://doi.org/10.21101/cejph.a7238
Kim, H., Park, S., Lee, M., & Oh, S. (2021). Association Between Depression and the Risk of Alzheimer’s Disease Using the Korean National Health Insurance Service Elderly Cohort. Scientific Reports, 11, 22591. https://doi.org/10.1038/s41598-021-02201-6
Livingston, G., Huntley, J., Sommerlad, A., Ames, D., Ballard, C., Banerjee, S., Brayne, C., Burns, A., Cohen-Mansfield, J., Cooper, C., Costafreda, S. G., Dias, A., Fox, N., Gitlin, L. N., Howard, R., Kales, H. C., Kivimäki, M., Larson, E. B., Ogunniyi, A., Orgeta, V., Ritchie, K., Rockwood, K., Sampson, E. L., Samus, Q., Schneider, L. S., Selbæk, G., & Teri, L. (2020). Dementia Prevention, Intervention, and Care: 2020 Report of the Lancet Commission. The Lancet, 396(10248), 413-446. https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)30367-6/fulltext
Nygård, L. (2003). Instrumental Activities of Daily Living: A Stepping-Stone Towards Alzheimer’s Disease Diagnosis in Subjects with Mild Cognitive Impairment? Acta Neurologica Scandinavica. Supplementum, 179, 42–46. https://pubmed.ncbi.nlm.nih.gov/12603250/
Ou, Y. N., Zhou, Y., Zhang, H., & Xu, W. (2020). Blood Pressure and Risks of Cognitive Impairment: A Systematic Review and Meta-Analysis of 209 Prospective Studies. Cognitive Disorders, 76(3), 217-225. https://doi.org/10.1161/HYPERTENSIONAHA.120.14993
Perez-Niveas, B. G., & Serrano-Pozo, A. (2018). Deciphering the Astrocyte Reaction in Alzheimer’s Disease. Frontiers in Aging Neuroscience, 10, 114. https://doi.org/10.3389/fnagi.2018.00114
Qin, J., Zhang, X., Liu, J., & Zhao, Y. (2021). Prevalence of Mild Cognitive Impairment in Patients with Hypertension: A Systematic Review and Meta-Analysis. Hypertension Research, 44(8), 1251–1260. https://doi.org/10.1038/s41440-021-00704-3
Rockwood, K., & Darvesh, S. (2003). The Risk of Dementia in Relation to Statins and Other Lipid Lowering Agents. Neurological Research, 25(6), 601-604. https://doi.org/10.1179/016164103101202039
Sakurai, H., Hanyu, H., Kanetaka, H., Sato, T., Shimizu, S., Hirao, K., & Iwamoto, T. (2010). Prevalence of Coexisting Diseases in Patients with Alzheimer’s Disease. Geriatrics & Gerontology International, 10(2), 216–217. https://doi.org/10.1111/j.1447-0594.2010.00609.x
Santiago, J. A., & Potashkin, J. A. (2021). The Impact of Disease Comorbidities in Alzheimer’s Disease. Frontiers in Aging Neuroscience, 13, 670800. https://doi.org/10.3389/fnagi.2021.631770
Sievert, C., & others. (2022). Plotly: Create Interactive Web Graphics Via ‘plotly.js’ [Computer software]. R-Cran. https://cran.r-project.org/web/packages/plotly/index.html
Skoog, I., Lernfelt, B., Landahl, S., Palmertz, B., Andreasson, L. A., Nilsson, L., Persson, G., Odén, A., & Svanborg, A. (1996). 15-Year Longitudinal Study of Blood Pressure and Dementia. Lancet, 347(9009), 1141–1145. https://doi.org/10.1016/s0140-6736(96)90608-x
Sonnen, J. A., Larson, E. B., & Smith, A. K. (2009). Different Patterns of Cerebral Injury in Dementia with or without Diabetes. Archives of Neurology, 66(3), 315-322. https://doi.org/10.1001/archneurol.2008.579
Steffens, D. C., Potter, G. G., & Plassman, B. L. (2000). Hippocampal Volume in Geriatric Depression. Biological Psychiatry, 48(3), 301–309. https://doi.org/10.1016/s0006-3223(00)00829-5
Tahami Monfared, A. A., Byrnes, M. J., White, L. A., & Zhang, Q. (2022). The Humanistic and Economic Burden of Alzheimer’s Disease. Neurology and Therapy, 11(2), 525–551. https://doi.org/10.1007/s40120-022-00335-x
Tekin, B., Elmacıoğlu, F., & Ülker, M. T. (2023). Alzheimer Disease-Type 3 Diabetes: Traditional Review. Turkiye Klinikleri Journal of Health Sciences, 8(1), 153-160.
Villemagne, V. L., Burnham, S., Bourgeat, P., Brown, B., Ellis, K. A., Salvado, O., & Rowe, C. C. (2013). Amyloid β Deposition, Neurodegeneration, and Cognitive Decline in Sporadic Alzheimer’s Disease: A Prospective Cohort Study. The Lancet Neurology, 12(4), 357-367.
Waldemar, G., Dubois, B., Emre, M., Georges, J., McKeith, I. G., Rossor, M., Scheltens, P., Tariska, P., & Winblad, B. (2007). Recommendations for the Diagnosis and Management of Alzheimer’s Disease and Other Disorders Associated with Dementia: EFNS Guideline. European Journal of Neurology, 14(1), 1-26. https://doi.org/10.1111/j.1468-1331.2006.01605.x
Wang, Y., Liu, L., Zhao, Y., & Xu, S. (2023). Onset age of Diabetes and Incident Dementia: A Prospective Cohort Study. Journal of Affective Disorders, 323, 493-499. https://doi.org/10.1016/j.jad.2023.02.138
Wingo, T. S., Gerasimov, E. S., Canon, S. M., Lah, J. J., Levey, A. I., & Wingo, A. P. (2022). Alzheimer’s Disease Genetic Burden is Associated with Mid-Life Depression Among Persons with Normal Cognition. Alzheimer’s & Dementia: The Journal of the Alzheimer’s Association. https://doi.org/10.1002/alz.12716
World Health Organization. (2023). Dementia. https://www.who.int/en/news-room/fact-sheets/detail/dementia
Zabala-Findlay, A., Aoyama, Y., Reiman, E. M., Fleisher, A. S., & Kokkinos, J. (2023). Utility of Blood-Based Tau Biomarkers for Mild Cognitive Impairment and Alzheimer’s Disease: Systematic Review and Meta-Analysis. Cells, 12(8), 1184. https://doi.org/10.3390/cells12081184
Türkiye Alzheimer ve Demans Büyük Veri Analizlerinin Görünümü

